Содержание
- 1 Калий и азот реакция
- 1.1 Осторожней с калием!
- 1.2 Азот, фосфор, калий – признаки недостатка и избытка у растений
- 1.3 Фосфор
- 1.4 Калий
- 1.5 Питание растений-азот, фосфор, калий. Как, когда и чем правильно подкармливать растения
- 1.6 Фосфор
- 1.7 Калий
- 1.8 Оксид калия: формула, взаимодействие
- 1.9 Что такое оксид?
- 1.10 Оксид калия: формула
- 1.11 Физические свойства
- 1.12 Химические свойства К2О
- 1.13 Реакция с водой
- 1.14 С другими оксидами
- 1.15 Взаимодействие с кислотами
- 1.16 К2О и галогены
- 1.17 Взаимодействие с аммиаком
- 1.18 Взаимодействие с органическими веществами
- 1.19 Получение К2О
- 1.20 Использование К2О в промышленности
Калий и азот реакция
Осторожней с калием!
Текст не мой, я лишь «причесал». О «безобидности» калия действительно много где написано. Кого интересует исходник, могу указать в комментариях. Текст приведён лишь как информация к размышлению, а не руководство к действию.

Как мы знаем, калий — важнейший элемент макро-удобрений в аквариуме. Считается, что он безобиден и может регулярно вноситься в аквариум практически бесконтрольно. Кроме того, в комплексных удобрениях всегда в составе есть калий, и он, конечно, всегда поэтому и вносится воду. Но так ли он безобиден? В каких дозах он нужен? Мой опыт говорит совсем иное: калий в больших дозах и регулярно может привести к тяжелейшим последствиям для растений.
Калий в воде аквариума
Калий не вносится в аквариум с кормом. Калий содержится в воде водопровода, но в густо засаженном аквариуме этого маловато. Растения реагируют на недостаток калия дырочками на листьях, рваными листьями и пожелтением кромок листа. Это все мы знаем, это написано везде… Увидел дырочки на листьях — лей калий… Однако не всё так просто и не всё укладывается в эту схему.
Например, вы удивитесь, но количество калия в аквариуме практически постоянно и в воде его содержание не должно быть заметным. Другими словами: всё должно быть усвоено растениями. Излишки калия в воде — признак умирания растений. Содержащиеся в тканях растения элементы растворяются в воде и т. д. Конечно, точных тестов на калий почти нет и судим мы о нём по косвенным признакам. А какие признаки мы видим? Недостаток! Нам и в голову не приходит, что дело как раз в передозировке!
Итак, с начала: увидел признак недостатка калия — лей калий. И вроде всё хорошо, но вот почему-то часто аквариумист замечает, что дырочки перерастают в жёлтые пятна и очаги гниения прямо посередине листа! Ну налицо недостаток фосфора! Увидел недостаток фосфора — лей фосфор. Налил? Смотри: растения полностью остановились в росте, причём почти все. Налицо признаки азотного голодания… Закрываются новые точки роста, осыпаются листья… Приехали: водоросли! Ну и, конечно, возникает мысль — это я фосфатов много дал. Передоз… Потом, правда, и азота плеснул, признаки-то были… Совсем немного… Но аквариум превратился в помойку, вода стала тяжёлая с желтизной. Полез ксен на людвигии. и т. д.
И калий тут вроде бы и не причём. А ведь с него всё и началось, просто это уже не так очевидно…
Повсюду в интернете написано: калий не приводит к росту водорослей. Лей не хочу! Калий не влияет на остановку роста растений! Поэтому на него и не грешим — он безобиден…
Разбираемся по цепочке. Итак, вы слегка передознули калия. Многие растения тут же вам сигнализируют об этом, например, ротала краснолистная. Она тут же закроет точки роста и скинет листья. Но это только начало. Аммания грацилис тоже тормознет, а она очень любит азот и железо. Причём тут калий? А вот причём. Калий при избытке резко тормозит усвоение кальция, количество которого в водопроводной воде Москвы стремятся свести к нулю. Ну это и понятно — накипь на стиральной машине никому не нужна. Получается, что в водопроводе мало калия… и кальция. Добавь калия и кальций для растений будет совсем недоступен!
Идём дальше. Калий при избытке замедляет усвоение азота, а тот в свою очередь полностью блокирует усвоение фосфора. Помните признаки фосфорного голода? А на самом деле в воде полно фосфатов! Но мы ещё добавили! Остановка роста растений полностью останавливает усвоение микроэлементов, а это, например, бор! И получили компот — полная идиллия для водорослей из всех макро- и микроэлементов. Растения им не конкурент! Передоз по всем элементам на ровном месте и без всяких причин. Такой передоз лечится не сразу и с трудом. Многие растения можно и не спасти.
Моё мнение: передозировка калия — самый тяжёлый вид передоза!
Калий нельзя вносить регулярно. В московской воде особенно. Только по необходимости и вместе с азотом и фосфатами. У меня удо самомесные — мне легко это регулировать, все элементы вношу отдельно по очереди.
Жёсткость воды (кальций) обеспечить ракушками и прочими доступными методами. Раз уж у нас нет тестов воды (а я ращу всё на глазок — так мне интереснее) смотрим внимательно на разные виды растений, они реагируют по-разному и с разной скоростью! По их реакции определяем где у нас засада!
У меня в аквариуме разные растения. Людвигия зеленая говорит мне о количестве органики в воде, азоте и фосфоре. Ротала индика — о железе и микро удо… Ротала краснолистная — о микро и кальции, и о PH… Аммания грацилис об азоте и железе, о фосфатах… Альтернантера — о состоянии ила и плодородности грунта, об азоте и фосфатах. Её внешние корни говорят о воде и ее удобренности… Её листья о свете и о росте водорослей. Погостемон эректус — о железе и азоте. Анубиас под лампой — о фосфатах. Криптокорина — ценитель железа и фосфора.. Как видно, если на всё внимательно смотреть, то можно весьма неплохо определять передоз и нехватку того или иного элемента.
Как же быть? Ну, во-первых, нужно усвоить, что нехватку калия не получить просто заменой воды и сразу. Должна быть причина, например растение, которое вы недавно внесли в банку, и его способность жрать калий. Например, ричия — очень частая проблема. Или, например, частая смена воды без добавления калия. Или резкий рост одних растений и остановка других… Всегда есть причина и нужно разобраться с ней. В конце концов нужно понять, что растения могут существовать (может и не расти, но существовать) вообще без удобрений! А раз так, то достаточно бывает уменьшить световой день на час или снизить температуру на градус для приведения аквариума в норму без риска передозировки!
Ну и главный итог — калий не безопасен и не так безобиден! ИМХО, конечно…
Азот, фосфор, калий – признаки недостатка и избытка у растений
Добавление статьи в новую подборку

Чтобы растение нормально развивалось, оно должно получать такие элементы питания, как азот, фосфор, калий, водород, кислород, углерод, магний, кальций, серу и железо. Первые 3 элемента из этого списка – самые важные и незаменимые. Узнайте почему.
В растении содержится порядка 70 химических элементов, которые выполняют определенные функции. Углерод, водород и кислород поступают в основном из атмосферы, поэтому для полноценного роста достаточно посадить растение в правильном месте. А вот чтобы обеспечить его азотом, фосфором и калием, нужно внести их в почву.
Остальные макро- и микроэлементы нужны растению в более малых количествах, особенно если оно не слишком прихотливое. Давайте разберемся, в чем же заключается важность азота, фосфора и калия для развития растительного организма.
Без азота в растении не могут образоваться белковые молекулы, которые являются основой любого живого организма. Так, в белке содержится около 18% азота.
Кроме того, этот макроэлемент является составляющей хлорофилла, без которого невозможен такой важный процесс, как фотосинтез. Именно поэтому при нехватке или избытке азота в первую очередь страдают листья.


Чтобы обеспечить растение азотом, применяют следующие удобрения:
- Аммиачную селитру. В ней 35% азота содержится в аммонийной и нитратной форме.
- Мочевину и карбамид. Это амидные удобрения, в которых содержится 46% азота.
- Сульфат аммония, или сернокислый аммоний (21% азота).
- Навоз и навозная жижа. Это органическое удобрение, содержащее весь спектр макроэлементов, которые необходимы растениям.
Азотные удобрения вносят весной и летом. Осенью не рекомендуется подкармливать азотом растения, находящиеся в открытом грунте, так как обильные осадки вымоют этот важный элемент из земли. К тому же азот способствует росту стеблей и листьев растения, что ближе к осени ему совсем не нужно. Учтите, что азотные удобрения нужно обязательно заделывать в почву, а не рассыпать на ее поверхности: иначе воздух и солнечные лучи значительно снизят концентрацию азота.
Больше всего к азоту чувствительны такие культуры, как капуста, картофель, томат, огурец, лук, свекла, яблоня, земляника, смородина.
Важно не переборщить с азотными удобрениями, особенно при внесении их в почву, где растут плодово-ягодные и овощные культуры, употребляемые в пищу. Дето в том, что излишний азот накапливается в плодах в виде нитратов, которые наносят существенный вред организму.
Фосфор
Этот макроэлемент входит в состав клеточного ядра, ферментов и некоторых витаминов. А кроме того, в минеральной форме фосфор участвует в синтезе углеводов.
Фосфорные удобрения способствуют росту корневой системы растения и повышают урожайность, поэтому они очень важны для овощных, зерновых, ягодных и плодовых культур.
О недостатке или передозировке фосфора в первую очередь свидетельствуют изменения окраски листьев.


Наиболее популярные фосфорные удобрения:
- Суперфосфат. Бывает простой (15-20% фосфора) и двойной (около 50% фосфора). Подходит как для открытого, так и для закрытого грунта.
- Фосфоритная мука (содержит 20-30% фосфора). В основном используется для подкормки полевых культур и может соединяться с любыми другими удобрениями.
Фосфор особенно необходим растениям перед началом цветения.
Калий
Калий участвует в белковом обмене и в усвоении углекислого газа. Благодаря этому макроэлементу улучшается синтез витамина С, в клеточном соке накапливается сахар, и, как следствие, стенки клеток утолщаются, иммунитет растения повышается.
Калий особенно важен для цветущих растений, так как при его дефиците бутоны либо вовсе не завязываются, либо цветки вырастают очень мелкими.
Если растению не хватает калия, в его клетках постепенно накапливается аммиак. Это приводит к неустойчивости растения к грибковым заболеваниям и отмиранию побегов. Чем же еще чреват недостаток или избыток калия?


Чтобы восполнить дефицит калия, растения нужно подкармливать калийными удобрениями. Все они хорошо растворяются в воде и обычно вносятся в почву осенью.
Самыми популярными являются:
- Хлористый калий. В удобрении содержится 44-60% калия и около 40% хлора. Последний задерживает рост и ухудшает качество урожая, поэтому хлористый калий вносят исключительно осенью: к началу вегетативного периода растения хлор уже успевает испариться.
- Сернокислый калий. Содержит 50% калия и около 20% серы. Подходит для подкормки любых культур.
- Калийная селитра. В удобрении содержится 45% калия и 15% азота, оно чаще всего используется в закрытом грунте.
- Калимагнезия. Содержит около 30% калия и 10-17% магния. Обычно применяется, если в почве не хватает магния.
- Калимаг. Это та же калимагнезия, только с примесью сульфата кальция и хлорида натрия. Содержание калия – 15-18%.
Больше всего в калийных удобрениях нуждаются подсолнечник, корнеплодные, клубнеплодные и овощные культуры.
Не забывайте правильно подкармливать растения на своем участке – и они порадуют вас привлекательным видом, пышным цветением и богатым урожаем.
Питание растений-азот, фосфор, калий. Как, когда и чем правильно подкармливать растения
Для полноценного развития растений, их роста, цветения и плодоношения недостаточно только солнечной энергии. Растениям нужно полноценное питание. Если почва достаточно плодородная, в ней достаточно много гумуса, она имеет оптимальную влажность и кислотность, большинству растений хватает почвенного питания.
Но такая идиллия бывает далеко не всегда. Почва на Вашем участке может быть бедной, песчаной, или слишком кислой/ щелочной, в которой питательные вещества оказываются в недоступных для растений соединениях. Здесь на помощь садоводам приходят удобрения.
Главные элементы питания растений, нужные им в достаточно больших количествах- это АЗОТ, ФОСФОР и КАЛИЙ
Давайте же разберемся, что нужно растениям в каждый из периодов их развития.
основной строительный материал, нужен для нормального роста вегетативной массы. Без достаточного количества азота растения выглядят угнетенными и чахлыми, низкого роста, с мелкими и бледными листьями, цветения и плодоношения от таких растений дождаться тоже трудно.
Азотные удобрения вносят весной и в начале лета. Избыток азота вреден- перекормленные им растения подвержены болезням и вредителям, дают обильную зелень в ущерб урожаю, склонны к вымерзанию зимой (понижается зимостойкость). Поэтому необходимо соблюдать меру, и обязательно обогащать почву также калием и фосфором. Особенно много азота необходимо растениям, которые регулярно стригутся- газонные травы, живая изгородь. К азотным удобрениям относятся:
Минеральные: мочевина (карбамид), сульфат аммония, селитры-аммиачная, калиевая, кальциевая.
Органические: навоз, птичий помет, перегной, компост, «зеленое удобрение» из сорняков.
Фосфор
необходим для нормального корневой системы, ускоряет цветение и начало плодоношения, играет важную роль в фотосинтезе, повышает урожайность, улучшает вызревание плодов и семян, повышает сахаристость плодов, повышает морозостойкость растений и устойчивость их к заболеваниям. Фосфором перекормить растения довольно сложно- они берут его из почвы ровно столько, сколько им нужно.
Фосфорные удобрения хорошо удерживаются в почве, их вносят как осенью под перекопку, так и весной при посадке. Летом во время бутонизации, цветения и созревания урожая предпочтительны жидкие подкормки. К фосфорным удобрениям относятся:
Минеральные: суперфосфат, двойной суперфосфат, фосфоритная мука.
Органические: древесная зола, костная мука
Калий
улучшает качество (способствует накоплению сахаров) и количество урожая (улучшает завязываемость, способствует наливу плодов), помогает усваивать микроэлементы, повышает устойчивость растений к засухе, морозам, грибковым заболеваниям и вредителям. Повышенные дозы калия необходимы постоянно цветущим однолетним растениям для пышного цветения.
Калийные удобрения вносят в начале бутонизации, цветения и плодообразования с интервалами 10-14 дней. Обычно достаточно двух-трехкратного внесения. К калийным удобрениям относятся:
Минеральные: хлористый калий, сульфат калия, калимагнезия
Органические: древесная зола, гумат калия.
Микробиологическое : «калийвит» (содержит микроорганизмы, которые переводят калий, содержащийся в почве, в доступные растениям формы)
Применяя удобрения, необходимо помнить, что лучшее-враг хорошего. Соблюдайте дозировку! Перекормить растения можно не только «химией», но и органикой, к примеру, внося много навоза, можно получить урожай овощей с избыточным содержанием нитратов, от которого пользы будет мало, да и храниться такие овощи будут плохо.
Оксид калия: формула, взаимодействие
В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь — из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно — о его физических и химических свойствах, о его применении в различных областях промышленности.

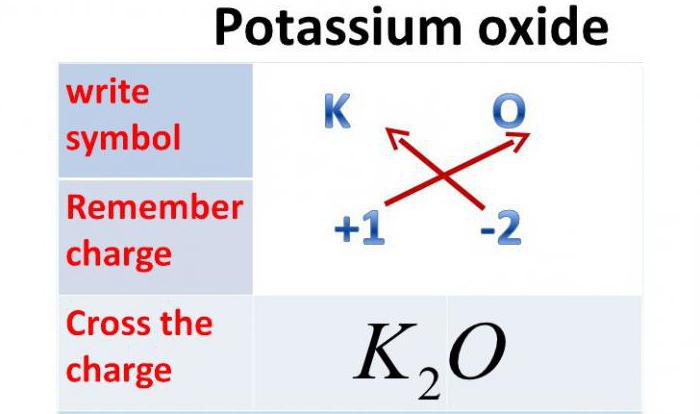
Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода — двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула — К2О.
Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см 3 .
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль — карбонат калия.

Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль — калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия — реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Взаимодействие с кислотами
Самый распространенный случай — оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой — хлорид и вода и так далее.
К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.

Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
Источники:
http://pikabu.ru/story/ostorozhney_s_kaliem_5635874
http://www.ogorod.ru/ru/now/fertilizers/9523/3-osnovnyh-elementa-pitanija-rastenij.htm
http://zen.yandex.ru/media/id/5a9bdfa7a815f1d7686d3088/5b31decf21aed500a9a005de
http://www.syl.ru/article/229823/new_oksid-kaliya-formula-vzaimodeystvie



