Содержание
- 1 Электроотрицательность атомов увеличивается в ряду
- 1.1 Тема №4 «Электроотрицательность, степень окисления и валентность химических элементов»
- 1.2 Электроотрицательность, степень окисления и валентность химических элементов
- 1.3 Оглавление
- 1.4 Электроотрицательность
- 1.5 Степень окисления
- 1.6 Валентность
- 1.7 Объясните почему электроотрицательность элементов в периодах увеличивается слева направо
- 1.8 Ответ или решение 2
- 1.9 Понятие о периодической системе Д. И. Менделеева
- 1.10 Понятие об электроотрицательности
- 1.11 Закономерности изменения электроотрицательности элементов в группе и периоде
- 1.12 1. Закономерности изменений значений электроотрицательности в периоде
- 1.13 2. Закономерности изменений значений электроотрицательности в группе
- 1.14 Объясните почему электроотрицательность элементов в периодах увеличивается слева направо
- 1.15 Ответ или решение 2
- 1.16 Понятие о периодической системе Д. И. Менделеева
- 1.17 Понятие об электроотрицательности
Электроотрицательность атомов увеличивается в ряду
Тема №4 «Электроотрицательность, степень окисления и валентность химических элементов»
В уроке изучаются понятия электроотрицательности, степени окисления, отличие степени окисления от валентности и понятие валентность. Идет обучение расчету степени окисления, в различных веществах, представлены решения заданий №4.
Электроотрицательность, степень окисления и валентность химических элементов
Оглавление
Электроотрицательность
В химии широко применяется понятие электроотрицательности (ЭО) — свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью. Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Имеется шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина. Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs

Наибольшее значение ЭО имеет фтор. Сопоставляя значения ЭО элементов от франция (0,86) до фтора (4,1), легко заметить, что ЭО подчиняется Периодическому закону. В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах — уменьшается (сверху вниз). В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.

Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи.
Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 – 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 – 0,93) = 2,23.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка расположена близко к ядру.
 Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем “добирать” электроны.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем “добирать” электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
 Степень окисления
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би — два), или двухэлементными (NaCl, HCl). В случае ионной связи в молекуле NaCl атом натрия передает свой внешний электрон атому хлора и превращается при этом в ион с зарядом +1, а атом хлора принимает электрон и превращается в ион с зарядом —1. Схематически процесс превращения атомов в ионы можно изобразить так:

При химическом взаимодействии в молекуле HCl общая электронная пара смещается в сторону более электроотрицательного атома. Например, , т. е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ: Н +0.18 Сl -0.18 . Если же представить, что и в молекуле HCl, как и в хлориде NaCl, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды +1 и -1:
, т. е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ: Н +0.18 Сl -0.18 . Если же представить, что и в молекуле HCl, как и в хлориде NaCl, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды +1 и -1:

Такие условные заряды называют степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных атомов.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов. Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:

Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т. е. атомы более электроотрицательных элементов. Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т. е. атомы менее электроотрицательных элементов. Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например:

В соединениях суммарная степень окисления всегда равна нулю.



 Валентность
Валентность
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
• числом неспаренных электронов (одноэлектронных орбиталей);
• наличием свободных орбиталей;
• наличием неподеленных пар электронов.
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е. его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4.
- H, Na, Li, К, Rb, Cs — Степень окисления I
- О, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd — Степень окисления II
- B, Al, Ga, In — Степень окисления III
- Сu — I и II
- Fe, Со, Ni — II и III
- С, Sn, Pb — II и IV
- P— III и V
- Cr — II, III и VI
- S — II, IV и VI
- Mn—II, III, IV, VI и VII
- N—II, III, IV и V
- Cl—I, IV, VIиVII
Используя валентности можно составить формулу соединения.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Например: Н2O-формула воды, где Н и О-химические знаки элементов, 2 — индекс, который показывает число атомов данного элемента, входящих в состав молекулы воды.
При названии веществ с переменной валентностью обязательно указывается его валентность, которая ставится в скобки. Например, Р205— оксид фосфора (V)
I. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю — Na 0 , Р4 0 , О2 0
II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0. а в сложном ионе его заряду.

Разберем для примера несколько соединений и узнаем валентность хлора:
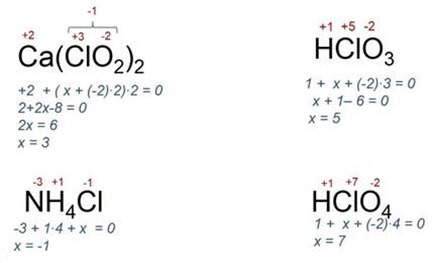



Справочный материал для прохождения тестирования:
Объясните почему электроотрицательность элементов в периодах увеличивается слева направо
Ответ или решение 2
![]()
Понятие о периодической системе Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева — это классификация химических элементов в виде таблицы, в которой четко видна зависимость различных свойств элементов от заряда атомного ядра. Данная система является графическим отображением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Создана была в 1869-1871 годах им же. Таблица состоит из столбцов (группы) и строк (периоды). Группы определяют основные физико-химические свойства элементов в связи с одинаковыми электронными конфигурациями на внешних электронных оболочках. В периодах химические элементы выстроены также в определенном порядке: возрастает заряда ядра, и заполняется электронами внешняя электронная оболочка. Хоть для групп и характерны более существенные тенденции и закономерности, но есть области, где горизонтальное направление более значимо и показательно, чем вертикальное. Это относится к блоку лантаноидов и актиноидов.
Понятие об электроотрицательности
Электроотрицательность является основополагающим химическим свойством атома. Этим термином обозначают относительную способность атомов в молекуле оттягивать к себе общие электронные пары. Электроотрицательность определяет тип и свойства химической связи, и таким образом влияет на характер взаимодействия между атомами в химических реакциях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), а низкая — у активных металлов (I группа). Современное понятие ввел американский химик Л. Полинг. Теоретическое же определение электроотрицательности предложил американский физик Р. Малликен.
Электроотрицательность химических элементов в периодической системе Д. И. Менделеева увеличивается вдоль периода слева направо, а в группах — снизу вверх. Электроотрицательность зависит от:
- атомного радиуса;
- количества электронов и электронных оболочек;
- энергии ионизации.
Так, в направлении слева направо радиус атомов обычно сокращается в связи с тем, что у каждого последующего элемента увеличивается количество заряженных частиц, поэтому электроны притягиваются сильнее и ближе к ядру. Это ведет к увеличению энергии ионизации, так как сильная связь в атоме требует большей энергии на изъятие электрона. Соответственно, увеличивается и электроотрицательность.
Закономерности изменения электроотрицательности элементов в группе и периоде
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти

На этом уроке вы узнаете о закономерностях изменения электроотрицательности элементов в группе и периоде. На нём вы рассмотрите, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучите закономерности изменения электроотрицательности элемента.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Закономерности изменений электроотрицательности химических элементов в группе и периоде
1. Закономерности изменений значений электроотрицательности в периоде
Закономерности изменений значений относительной электроотрицательности в периоде
Рассмотрим на примере элементов второго периода, закономерности изменений значений их относительной электроотрицательности. Рис.1.

Рис. 1. Закономерности изменений значений электроотрицательности элементов 2 периода
Относительная электроотрицательность химического элемента зависит от заряда ядра и от радиуса атома. Во втором периоде находятся элементы: Li, Be, B, C, N, O, F, Ne. От лития до фтора увеличивается заряд ядра и количество внешних электронов. Число электронных слоев остается неизменным. Значит, сила притяжения внешних электронов к ядру будет возрастать, и атом будет как бы сжиматься. Радиус атома от лития до фтора будет уменьшаться. Чем меньше радиус атома, тем сильнее внешние электроны притягиваются к ядру, а значит больше значение относительной электроотрицательности.
В периоде с увеличением заряда ядра радиус атома уменьшается, а значение относительной электроотрицательности увеличивается.

Рис. 2. Закономерности изменений значений электроотрицательности элементов VII-A группы.
2. Закономерности изменений значений электроотрицательности в группе
Закономерности изменений значений относительной электроотрицательности в главных подгруппах
Рассмотрим закономерности изменений значений относительной электроотрицательности в главных подгруппах на примере элементов VII-A группы. Рис.2. В седьмой группе главной подгруппе расположены галогены: F, Cl, Br, I, At. На внешнем электроном слое у этих элементов одинаковое число электронов – 7. С возрастанием заряда ядра атома при переходе от периода к периоду, увеличивается число электронных слоев, а значит, увеличивается атомный радиус. Чем меньше радиус атома, тем больше значение электроотрицательности.
В главной подгруппе с увеличением заряда ядра атома радиус атома увеличивается, а значение относительной электроотрицательности уменьшается.
Так как химический элемент фтор расположен в правом верхнем углу Периодической системы Д.И.Менделеева его значение относительной электроотрицательности будет максимальным и численно равным 4.
Вывод: Относительная электроотрицательность увеличивается с уменьшением радиуса атома.
В периодах с увеличением заряда ядра атома электроотрицательность увеличивается.
В главных подгруппах с увеличением заряда ядра атома относительная электроотрицательность химического элемента уменьшается. Самый электроотрицательный химический элемент – это фтор, так как он расположен в правом верхнем углу Периодической системы Д.И.Менделеева.
Подведение итога урока
На этом уроке вы узнали о закономерностях изменения электроотрицательности элементов в группе и периоде. На нём вы рассмотрели, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучили закономерности изменения электроотрицательности элемента.
Список рекомендованной литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с .
Рекомендованные ссылки на ресурсы интернет
Рекомендованное домашнее задание
1. №№ 1,2,5 (с.145) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Приведите примеры веществ с ковалентной неполярной связью и ионной. Какое значение имеет электроотрицательность в образовании таких соединений?
3. Расположите в ряд по возрастанию электроотрицательности элементы второй группы главной подгруппы.
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

Объясните почему электроотрицательность элементов в периодах увеличивается слева направо
Ответ или решение 2
![]()
Понятие о периодической системе Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева — это классификация химических элементов в виде таблицы, в которой четко видна зависимость различных свойств элементов от заряда атомного ядра. Данная система является графическим отображением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Создана была в 1869-1871 годах им же. Таблица состоит из столбцов (группы) и строк (периоды). Группы определяют основные физико-химические свойства элементов в связи с одинаковыми электронными конфигурациями на внешних электронных оболочках. В периодах химические элементы выстроены также в определенном порядке: возрастает заряда ядра, и заполняется электронами внешняя электронная оболочка. Хоть для групп и характерны более существенные тенденции и закономерности, но есть области, где горизонтальное направление более значимо и показательно, чем вертикальное. Это относится к блоку лантаноидов и актиноидов.
Понятие об электроотрицательности
Электроотрицательность является основополагающим химическим свойством атома. Этим термином обозначают относительную способность атомов в молекуле оттягивать к себе общие электронные пары. Электроотрицательность определяет тип и свойства химической связи, и таким образом влияет на характер взаимодействия между атомами в химических реакциях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), а низкая — у активных металлов (I группа). Современное понятие ввел американский химик Л. Полинг. Теоретическое же определение электроотрицательности предложил американский физик Р. Малликен.
Электроотрицательность химических элементов в периодической системе Д. И. Менделеева увеличивается вдоль периода слева направо, а в группах — снизу вверх. Электроотрицательность зависит от:
- атомного радиуса;
- количества электронов и электронных оболочек;
- энергии ионизации.
Так, в направлении слева направо радиус атомов обычно сокращается в связи с тем, что у каждого последующего элемента увеличивается количество заряженных частиц, поэтому электроны притягиваются сильнее и ближе к ядру. Это ведет к увеличению энергии ионизации, так как сильная связь в атоме требует большей энергии на изъятие электрона. Соответственно, увеличивается и электроотрицательность.
Источники:
http://www.chem-mind.com/2017/03/08/%D1%82%D0%B5%D0%BC%D0%B0-%E2%84%964-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BE%D1%82%D1%80%D0%B8%D1%86%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D1%81%D1%82%D1%8C-%D1%81%D1%82%D0%B5%D0%BF/
http://vashurok.ru/questions/obyasnite-pochemu-elektrootritsatelnost-elementov-v-periodah-uvelichivaetsya-sleva-naprav
http://interneturok.ru/lesson/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/zakonomernosti-izmeneniya-elektrootritsatelnosti-elementov-v-gruppe-i-periode
http://vashurok.ru/questions/obyasnite-pochemu-elektrootritsatelnost-elementov-v-periodah-uvelichivaetsya-sleva-naprav




 Степень окисления
Степень окисления Валентность
Валентность
