Содержание
- 1 Нейтральная среда ph это сколько
- 1.1 ВАЖНО! Роль РН и кислотно-щелочного равновесия в организме
- 1.2 Организм имеет разный уровень PH
- 1.3 Кислая среда и щелочная среда: определение и свойства. Ph-тест
- 1.4 Возникновение понятия
- 1.5 Расчет кислотности
- 1.6 Свойства кислой среды
- 1.7 Свойства щелочной среды
- 1.8 Практическое определение кислотности
- 1.9 Кислотность различных сред в быту
- 1.10 Кислотность и здоровье
- 1.11 Нейтральная среда ph это сколько
- 1.12 Кислотность почвы — важность pH грунта для растений
- 1.13 Что такое рН и ее значение
- 1.14 Почему меняется кислотность почвенной среды
- 1.15 Как скорректировать кислотность
- 1.16 Как быстро определить рН
Нейтральная среда ph это сколько
ВАЖНО! Роль РН и кислотно-щелочного равновесия в организме
Ткани живого организма весьма чувствительны к колебаниям показателя pH — за пределами допустимого диапазона, происходит денатурация белков: разрушаются клетки, ферменты теряют способность выполнять свои функции, возможна гибель организма
Что такое РН (водородный показатель) и кислотно-щелочное равновесие
Соотношение кислоты и щелочи в каком-либо растворе называется кислотно-щелочным равновесием (КЩР), хотя физиологи считают, что более правильно называть это соотношение кислотно-щелочным состоянием.
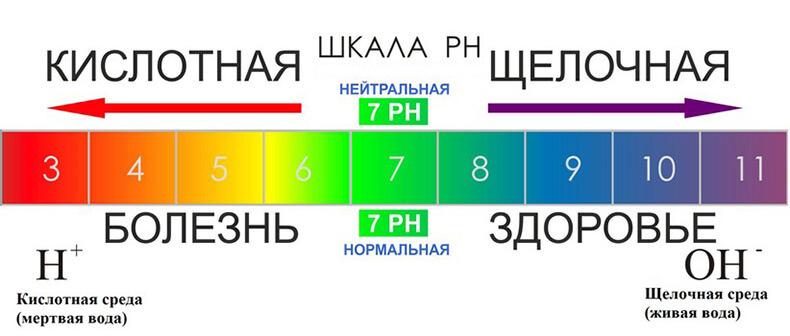
КЩР характеризуется специальным показателем рН (power Hydrogen — «сила водорода»), который показывает число водородных атомов в данном растворе. При рН равном 7,0 говорят о нейтральной среде.
Чем ниже уровень рН — тем среда более кислая (от 6,9 до О).
Щелочная среда имеет высокий уровень рН (от 7,1 до 14,0).
Тело человека на 70% состоит из воды, поэтому вода — это одна из наиболее важных его составляющих. Тело человека имеет определенное кислотно-щелочное соотношение, характеризуемое рН (водородным) показателем.
Значение показателя рН зависит от соотношения между положительно заряженными ионами (формирующими кислую среду) и отрицательно заряженными ионами (формирующими щелочную среду).
Организм постоянно стремится уравновесить это соотношение, поддерживая строго определенный уровень рН. При нарушенном балансе могут возникнуть множество серьезных заболеваний.
Соблюдайте правильный рН баланс для сохранения крепкого здоровья
Организм способен правильно усваивать и накапливать минералы и питательные вещества только при надлежащем уровне кислотно-щелочного равновесия. Ткани живого организма весьма чувствительны к колебаниям показателя pH — за пределами допустимого диапазона, происходит денатурация белков: разрушаются клетки, ферменты теряют способность выполнять свои функции, возможна гибель организма. Поэтому кисло́тно-щелочно́й баланс в организме жёстко регулируется.
Наш организм использует соляную кислоту для расщепления пищи. В процессе жизнедеятельности организма требуются как кислые, так и щелочные продукты распада, причем первых образуется больше чем вторых. Поэтому защитные системы организма, обеспечивающие неизменность его КЩР, «настроены» прежде всего на нейтрализацию и выведение прежде всего кислых продуктов распада.
Кровь имеет слабощелочную реакцию: pH артериальной крови составляет 7,4, а венозной — 7,35 (вследствие избытка С02).
Сдвиг рН хотя бы на 0,1 может привести к тяжелой патологии.
При сдвиге рН крови на 0,2 развивается коматозное состояние, на 0,3 — человек погибает.
Организм имеет разный уровень PH
Слюна — преимущественно щелочная реакция (колебание рН 6,0 — 7,9)
Обычно кислотность смешанной слюны человека равна 6,8–7,4 pH, но при большой скорости слюноотделения достигает 7,8 pH. Кислотность слюны околоушных желёз равна 5,81 pH, подчелюстных — 6,39 pH. У детей в среднем кислотность смешанной слюны равна 7,32 pH, у взрослых — 6,40 pH (Римарчук Г.В. и др.). Кислотно-щелочное равновесие слюны в свою очередь определяется аналогичным равновесием в крови, которая питает слюнные железы.
Пищевод — Нормальная кислотность в пищеводе 6,0–7,0 рН.
Печень — реакция пузырной желчи близка к нейтральной (рН 6,5 — 6,8), реакция печеночной желчи щелочная (рН 7,3 — 8,2)
Желудок — резко кислая (на высоте пищеварения рН 1,8 — 3,0)
Максимальная теоретически возможная кислотность в желудке 0,86 рН, что соответствует кислотопродукции 160 ммоль/л. Минимальная теоретически возможная кислотность в желудке 8,3 рН, что соответствует кислотности насыщенного раствора ионов HCO3 — . Нормальная кислотность в просвете тела желудка натощак 1,5–2,0 рН. Кислотность на поверхности эпителиального слоя, обращённого в просвет желудка 1,5–2,0 рН. Кислотность в глубине эпителиального слоя желудка около 7,0 рН. Нормальная кислотность в антруме желудка 1,3–7,4 рН.
Распространено заблуждение, что основная проблема для человека — это повышенная кислотность желудка. От нее изжога и язва.
На самом деле, гораздо большую проблему представляет пониженная кислотность желудка, которая встречается во много раз чаще.
Главной причиной возникновения изжоги в 95% является не избыток, а недостаток соляной кислоты в желудке.
Соляная кислота убивает попадающие в желудок микробы и различные паразиты. Кроме того, соляная кислота запускает пищеварение во всем желудочно-кишечном тракте, благодаря чему микробы и паразиты расщепляются пищеварительными ферментами.
Недостаток соляной кислоты создает идеальные условия для колонизации кишечного тракта различными бактериями, простейшими и червями.
Коварство ситуации в том, что пониженная кислотность желудка «ведет себя тихо» и протекает незаметно для человека.
Вот перечень признаков, которые позволяют заподозрить снижение кислотности желудка.
- Дискомфорт в желудке после еды.
- Тошнота после приема лекарств.
- Метеоризм в тонком кишечнике.
- Послабления стула или запор.
- Непереваренные частицы пищи в стуле.
- Зуд вокруг ануса.
- Множественные пищевые аллергии.
- Дисбактериоз или кандидоз.
- Расширенные кровеносные сосуды на щеках и носе.
- Угри.
- Слабые, расслаивающиеся ногти.
- Анемии из-за плохого всасывания железа.
Разумеется, точный диагноз пониженной кислотности требует определения рН желудочного сока (для этого необходимо обратиться к гастроэнтерологу).
Когда кислотность повышена — существует масса препаратов для ее снижения.
В случае же пониженной кислотности эффективных средств очень мало.
Как правило, используются препараты соляной кислоты или растительные горечи, стимулирующие отделение желудочного сока (полынь, аир, мята перечная, фенхель и др.).
Поджелудочная железа — панкреатический сок слабощелочной (рН 7,5 — 8,0)
Тонкий кишечник — щелочная реакция (рН 8,0)
Нормальная кислотность в луковице двенадцатиперстной кишки 5,6–7,9 рН. Кислотность в тощей и подвздошной кишках нейтральная или слабощелочная и находится в пределах от 7 до 8 рН. Кислотность сока тонкой кишки 7,2–7,5 рН. При усилении секреции достигает 8,6 рН. Кислотность секрета дуоденальных желез — от рН от 7 до 8 рН.
Толстый кишечник — слабо-кислая реакция (5.8 — 6.5 pH)
Это слабо-кислая среда, которая поддерживается нормальной микрофлорой, в частности,бифидобактериями, лактобактериями и пропионобактерими за счет того, что они нейтрализуют щелочные продукты метаболизма и вырабатывают свои кислые метаболиты — молочную кислоту и другие органические кислоты. Продуцируя органические кислоты и снижая рН кишечного содержимого, нормальная микрофлора создает условия, при которых патогенные и условно-патогенные микроорганизмы не могут размножаться. Собственно поэтому стрептококки, стафилококки, клебсиеллы, клостридии грибы и другие “плохие” бактерии составляют всего 1% от всей микрофлоры кишечника здорового человека.
Моча — преимущественно слабо-кислая реакция (рН 4,5- 8)
При пище с животными белками, содержащими серу и фосфор, в основном в основном выделяется кислая моча (рН менее 5); в конечной моче присутствует значительное количество неорганических сульфатов и фосфатов. Если пища в основном молочная или растительная, то моча имеет тенденцию к защелачиванию (рН более 7). Почечные канальцы играют значительную роль в поддержании кислотно-основного равновесия. Кислая моча будет выделяться при всех состояниях, приводящих к метаболическому или дыхательному ацидозу, так как почки компенсируют сдвиги кислотно-основного состояния.
Кожа — слабо-кислая реакция (рН 4- 6)
Если кожа склонна к жирности, значение рН может приближаться к 5,5. А если кожа очень сухая, рН может составлять и 4,4.
Бактерицидное свойство кожи, придающее ей способность противостоять микробной инвазии, обусловлено кислой реакцией кератина, своеобразным химическим составом кожного сала и пота, наличием на ее поверхности защитной воднолипидной мантии с высокой концентрацией водородных ионов. Входящие в ее состав низкомолекулярные жирные кислоты, в первую очередь гликофосфолипиды и свободные жирные кислоты, обладают бактериостатическим эффектом, селективным для патогенных микроорганизмов.
Половые органы
Нормальная кислотность влагалища женщины колеблется от 3,8 до 4,4 pH и в среднем составляет 4,0–4,2 pH.
При рождении влагалище девочки стерильно. Затем в течение нескольких дней оно заселяется разнообразными бактериями, в основном стафилококками, стрептококками, анаэробами (то есть бактериями, для жизни которых не требуется кислород). До начала менструаций уровень кислотности (pH) влагалища близок к нейтральному (7,0). Но в период полового созревания стенки влагалища утолщаются (под влиянием эстрогена — одного из женских половых гормонов), рН снижается до 4,4 (т.е. кислотность повышается), что вызывает изменения во влагалищной флоре.
Полость матки в норме стерильна, и попаданию в нее болезнетворных микроорганизмов препятствуют лактобактерии, заселяющие влагалище и поддерживающие высокую кислотность его среды. Если по каким-либо причинам кислотность влагалища сдвигается в сторону щелочной, численность лактобактерий резко падает, а на их месте развиваются другие микробы, которые могут попасть в матку и привести к воспалению, а затем, и к проблемам с беременностью.
Сперма
Нормальный уровень кислотности спермы находится в пределах от 7,2 до 8,0 рН. Увеличение уровня рН спермы происходит при инфекционном процессе. Резко щелочная реакция спермы (кислотность примерно 9,0–10,0 рН) свидетельствует о патологии предстательной железы. При закупорке выводных протоков обоих семенных пузырьков отмечается кислая реакция спермы (кислотность 6,0–6,8 рН). Оплодотворяющая способность такой спермы снижена. В кислой среде сперматозоиды теряют подвижность и погибают. Если кислотность семенной жидкости становится меньше 6,0 рН, сперматозоиды полностью теряют подвижность и погибают.
Клетки и межклеточная жидкость
В клетках организма рН имеет значение около 7, во внеклеточной жидкости — 7,4. Нервные окончания, которые находятся вне клеток, очень чувствительны к изменению рН. При механических или термических повреждениях тканей стенки клеток разрушаются и их содержимое попадает на нервные окончания. В результате человек чувствует боль.
Скандинавский исследователь Олаф Линдал проделал такой эксперимент: с помощью специального безыгольного инъектора человеку впрыскивали сквозь кожу очень тонкую струйку раствора, которая не повреждала клетки, но действовала на нервные окончания. Было показано, что боль вызывают именно катионы водорода, причем с уменьшением рН раствора боль усиливается.
Аналогично непосредственно «действует на нервы» и раствор муравьиной кислоты, который жалящие насекомые или крапива впрыскивают под кожу. Разным значением рН тканей объясняется также, почему при некоторых воспалениях человек чувствует боль, а при некоторых — нет.
Интересно, что впрыскивание под кожу чистой воды дало особенно сильную боль. Объясняется это странное на первый взгляд явление так: клетки при контакте с чистой водой в результате осмотического давления разрываются и их содержимое воздействует на нервные окончания.
Таблица 1. Водородные показатели для растворов
Кислая среда и щелочная среда: определение и свойства. Ph-тест
Кислоты и щелочи — два крайних положения одной шкалы: их свойства (совершенно противоположные) обусловливает одна и та же величина — концентрация ионов водорода (H+). Однако само по себе это число очень неудобное: даже в кислых средах, где концентрация ионов водорода выше, это число составляет сотые, тысячные доли единицы. Поэтому для удобства пользуются десятичным логарифмом этого значения, умноженным на минус один. Принято говорить, что это pH (potentia Hydrogen), или же водородный показатель.
Возникновение понятия
 Вам будет интересно: Какие свойства воздуха использует костер? Или все-таки люди, его разжигая?
Вам будет интересно: Какие свойства воздуха использует костер? Или все-таки люди, его разжигая?
Вообще тот факт, что кислая среда и щелочная среда определяются концентрацией ионов водорода H+ и что чем выше их концентрация, тем раствор более кислый (и наоборот, чем ниже концентрация H+, тем более щелочная среда и выше концентрация противоположных ионов OH-), был известен науке достаточно давно. Однако лишь в 1909 году датский химик Серенсен впервые опубликовал исследования, в которых пользовался понятием водородного показателя — PH, впоследствии замененным на pH.
Расчет кислотности

При расчете водородного показателя исходят из того, что молекулы воды в растворе, хоть и в очень малых количествах, все же диссоциируют на ионы. Эта реакция называется автопротолизом воды:
Реакция обратима, поэтому для нее определена константа равновесия (показывающая, какие в среднем устанавливаются концентрации каждого компонента). Здесь дано значение константы для стандартных условий — температуры 22 °С.
Внизу в квадратных скобках — молярные концентрации указанных компонентов. Молярная концентрация воды в воде — приблизительно 55 моль/литр, то есть величина второго порядка. Следовательно, произведение концентраций ионов H+ и OH- — около 10-14. Эта величина называется ионным произведением воды.
В чистой воде концентрации ионов водорода и гидроксид-ионов равны 10-7. Соответственно, водородный показатель воды будет приблизительно 7. Это значение pH принимают за нейтральную среду.

Далее нужно отвлечься от воды и рассмотреть раствор какой-нибудь кислоты или щелочи. Возьмем, например, уксусную кислоту. Ионное произведение воды останется прежним, однако баланс между ионами H+ и OH- сместится в сторону первых: ионы водорода придут от частично продиссоциировавшей уксусной кислоты, а «лишние» гидроксид-ионы уйдут в недиссоциировавшие молекулы воды. Таким образом, концентрация ионов водорода будет выше, и pH будет меньше (не надо забывать, что логарифм берется со знаком «минус»). Соответственно, кислая среда и щелочная среда связаны с pH. И связаны следующим образом. Чем меньше значение водородного показателя, тем более кислая среда.
Свойства кислой среды
Кислая среда — это растворы с pH меньше 7. Следует оговориться, что, хотя значение ионного произведения воды на первый взгляд ограничивает значения водородного показателя в пределах от 1 до 14, на самом деле растворы с pH меньше единицы (и даже меньше нуля) и больше 14 существуют. Например, в концентрированных растворах сильных кислот (серной, соляной) pH может достигать -2.
 Вам будет интересно: Термин таймшит. Таймшит — это.
Вам будет интересно: Термин таймшит. Таймшит — это.
От того, имеем ли мы кислую среду или среду щелочную, может зависеть растворимость некоторых веществ. Например, возьмем гидроксиды металлов. Растворимость определяется величиной произведения растворимости, которое по структуре есть то же, что и ионное произведение воды: перемноженные концентрации. В случае с гидроксидом в произведение растворимости входит концентрация иона металла и концентрация гидроксид-ионов. В случае избытка ионов водорода (в кислой среде) они будут активнее «вырывать» гидроксид-ионы из осадка, тем самым смещая равновесие в сторону растворенной формы, повышая растворимость осадка.
Также стоит упомянуть, что весь пищеварительный тракт человека имеет кислую среду: pH желудочного сока колеблется от 1 до 2. Отклонение от этих значений в меньшую или большую сторону может являться признаком различных заболеваний.
Свойства щелочной среды
В щелочной среде водородный показатель принимает значения, превышающие 7. Для удобства в средах с высокой концентрацией гидроксид-ионов вместо водородного показателя кислотности pH пользуются показателем основности pOH. Нетрудно догадаться, что он обозначает величину, равную -lg[OH-] (отрицательный десятичный логарифм концентрации гидроксид-ионов). Непосредственно из ионного произведения воды следует равенство pH + pOH =14. Поэтому pOH = 14 — pH. Таким образом, у всех утверждений, верных для показателя кислотности pH, верны обратные утверждения для показателя основности pOH. Если pH щелочной среды большой по определению, то ее pOH, очевидно, маленький, и чем сильнее раствор щелочи, тем меньше показатель pOH.
В этом предложении только что появился логический парадокс, вносящий путаницу во многие рассуждения о кислотности: маленький показатель кислотности обозначает высокую кислотность среды, и наоборот: большие значения pH соответствуют низкой кислотности. Этот парадокс появляется потому, что логарифм берется со знаком минус, и шкала кислотности как бы инвертируется.
Практическое определение кислотности
Для определения кислотности среды применяются так называемые индикаторы. Обычно это достаточно сложно устроенные органические молекулы, которые меняют свой цвет в зависимости от pH среды. Индикатор меняет свой цвет в очень узком интервале pH: это используется в кислотно-основном титровании, чтобы добиться точных результатов: титрование прекращают, как только индикатор меняет цвет.
Наиболее известные индикаторы — метиловый оранжевый (интервал перехода в области с маленьким pH), фенолфталеин (интервал перехода в области с большим pH), лакмус, тимоловый голубой и другие. В кислых средах и щелочных средах применяются разные индикаторы в зависимости от того, в какой области лежит их интервал перехода.
Существуют также универсальные индикаторы — они меняют свой цвет постепенно с красного на глубоко фиолетовый при переходе из сильно кислотных сред в сильно щелочные. На самом деле универсальные индикаторы представляют собой смесь из обычных.

Для более точного определения кислотности используют прибор — pH-метр (потенциометр, метод, соответственно, называется потенциометрия). Его принцип работы основан на измерении ЭДС в цепи, элементом которой является раствор с измеряемым pH. Потенциал электрода, погруженного в раствор, чувствителен к концентрации ионов водорода в растворе — отсюда изменение ЭДС, на основании которого рассчитывается реальный pH.

Кислотность различных сред в быту
Показатель кислотности имеет большое значение в повседневной жизни. Например, слабые кислоты — уксусная, яблочная — используются в качестве консервантов. Щелочные растворы являются моющими средствами, в том числе и мыло. Самое простое мыло представляет собой натриевые соли жирных кислот. В воде они диссоциируют: остаток жирной кислоты — очень длинный — с одной стороны имеет отрицательный заряд, а с другой своей стороны — длинную неполярную цепочку атомов углерода. Тот конец молекулы, на котором заряд участвует в гидратации, собирает вокруг себя молекулы воды. Второй конец присоединяется к другим неполярным вещам, например, молекулам жира. В результате образуются мицеллы — шарики, у которых наружу торчат «хвосты» с отрицательным зарядом, а внутри спрятаны «хвосты» и частички жира и грязи. Поверхность отмывается от жира и грязи за счет того, что моющее средство связывает весь жир и грязь в такие мицеллы.
Кислотность и здоровье
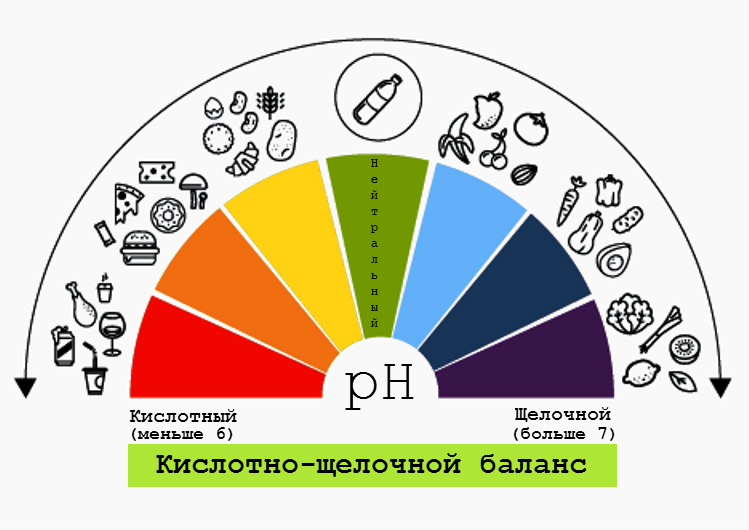
Уже было упомянуто, что pH имеет большое значение для человеческого организма. Кроме пищеварительного тракта, показатель кислотности важно контролировать и в других частях организма: кровь, слюна, кожа — для многих биологических процессов имеют большое значение кислая среда и щелочная среда. Их определение позволяет оценить состояние организма.
Сейчас набирают популярность pH-тесты — так называемые экспресс-тесты для проверки кислотности. Они представляют собой обычные полоски универсальной индикаторной бумаги.
Нейтральная среда ph это сколько
Кислотно-щелочное равновесие.
Показатель pH и его влияние на качество питьевой воды.
Что такое pH?
pH («potentia hydrogeni» — сила водорода, или «pondus hydrogenii» — вес водорода) — это единица измерения активности ионов водорода в любом веществе, количественно выражающая его кислотность.
Данный термин появился в начале ХХ века в Дании. Показатель pH ввел датский химик Сорен Петр Лауриц Соренсен (1868-1939), хотя утверждения о некой «силе воды» встречаются и у его предшественников.
Активность водорода определяется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+]
Для простоты и удобства при вычислениях был введен показатель pH. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Принято измерять уровень pH по 14-цифровой шкале.

Если в воде пониженное содержание свободных ионов водорода [H+] (рН больше 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН меньше 7) — кислую реакцию. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга.
кислая среда: [H+] > [OH-]
нейтральная среда: [H+] = [OH-]
щелочная среда: [OH-] > [H+]
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. В нейтральной воде показатель рН равен 7.
При растворении в воде различных химических веществ этот баланс изменяется, что приводит к изменению значения рН. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении щелочи — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает.
рН показатель отражает степень кислотности или щелочности среды, в то время как «кислотность» и «щелочность» характеризуют количественное содержание в воде веществ, способных нейтрализовывать соответственно щелочи и кислоты. В качестве аналогии можно привести пример с температурой, которая характеризует степень нагрева вещества, но не количество тепла. Опустив руку в воду, мы можем сказать какая вода — прохладная или теплая, но при этом не сможем определить сколько в ней тепла (т.е. условно говоря, как долго эта вода будет остывать).
pH считается одним из важнейших показателей качества питьевой воды. Он показывает кислотно-щелочное равновесие и влияет на то, как будут протекать химические и биологические процессы. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д. От кислотно-щелочного равновесия среды нашего организма напрямую зависит наше самочувствие, настроение и здоровье.
Современный человек живет в загрязненной окружающей среде. Многие приобретают и употребляют пищу, изготовленную из полуфабрикатов. Кроме этого практически каждый человек ежедневно подвергается стрессовому воздействию. Все это оказывает влияние на кислотно-щелочное равновесие среды организма, смещая его в сторону кислот. Чай, кофе, пиво, газированные напитки снижают показатель pH в организме.
Считается, что кислая среда является одной из основных причин разрушения клеток и повреждения тканей, развития заболеваний и процессов старения, росту болезнетворных организмов. В кислой среде до клеток не доходит строительный материал, разрушается мембрана.
Кислая среда провоцирует множество заболеваний, среди которых сердечно-сосудистые заболевания, артрит, остеопороз, онкологические заболевания и др, а так же способствует развитию бактерий, вирусов, грибков, гельминтов и прочих паразитов. Паразиты предпочитают кислую среду обитания, и именно в кислотной среде они проявляют себя наиболее патогенно. Кислую среду в организме создают психические и физические перегрузки, мясо, пища, прошедшая глубокую термическую и иную технологическую обработку, снижающую содержание в ней полезных веществ. Эти же источники закисления наполняют организм свободными радикалами, которые перегружают иммунную систему. Один из признаков закисления организма — некомфортная сухость во рту.
Внешне о состоянии кислотно-щелочного равновесия крови человека можно судить по цвету его конъюнктивы в уголках глаз. При оптимальном кислотно-щелочном балансе цвет конъюнктивы ярко-розовый, если же у человека повышается щелочность крови, конъюнктива приобретает темно-розовый окрас, а при повышении кислотности окрас конъюнктивы становится бледно-розовым. При чем цвет конъюнктивы изменяется уже через 80 секунд после употребления веществ, влияющих на кислотно-щелочное равновесие.
Организм регулирует рН внутренних жидкостей, поддерживая значения на определенном уровне. Кислотно-щелочной баланс организма — это определенное соотношение кислот и щелочей, способствующее его нормальному функционированию. Кислотно-щелочной баланс зависит от сохранения относительно постоянных пропорций между межклеточными и внутриклеточными водами в тканях организма. Если кислотно-щелочное равновесие жидкостей в организме не будет поддерживаться постоянно, нормальное функционирование и сохранение жизни окажутся невозможными. Поэтому важно контролировать то, что вы потребляете.

Кислотно-щелочной баланс – это наш индикатор здоровья. Чем мы «кислее», тем скорее стареем и больше болеем. Для нормальной работы всех внутренних органов уровень рН в организме должен быть щелочным, в интервале от 7 до 9.
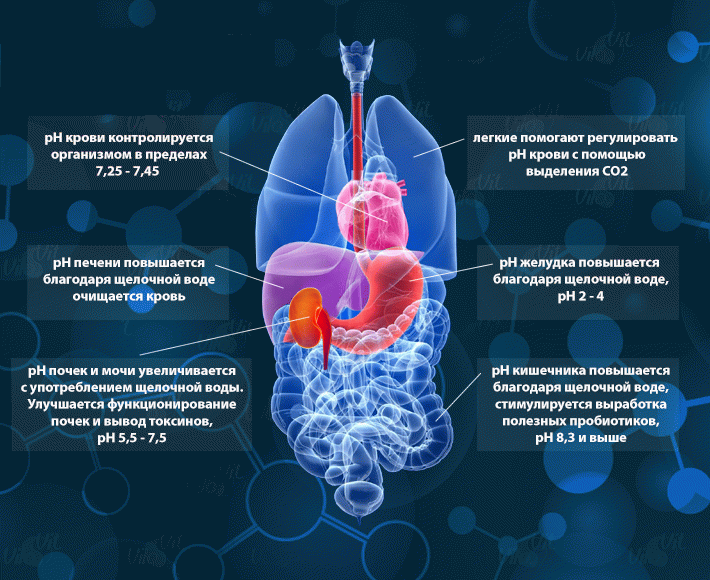
pH внутри нашего тела не всегда одинаков — некоторые его части более щелочные, а некоторые кислотные. Организм регулирует и поддерживает гомеостаз уровня pH лишь в отдельных случаях, например pH крови. На уровень pH почек и других органов, кислотно-щелочное равновесие которых не регулируются организмом, влияют пища и напитки, которые мы употребляем.
pH крови
Уровень pH крови поддерживается организмом в диапазоне 7.35-7.45. Нормальным показателем pH крови человека считается 7,4-7,45. Даже незначительное отклонение этого показателя влияет на способность крови переносить кислород. Если pH крови повышается до 7,5, она переносит на 75% кислорода больше. При снижении показателя pH крови до 7,3 человеку уже сложно подняться с постели. При 7,29 он может впасть в кому, если показатель pH крови снизится ниже 7,1 — человек умирает.
Уровень pH крови должен поддерживаться в здоровом диапазоне, поэтому организм использует органы и ткани для поддержания его постоянства. Вследствие этого, уровень pH крови не меняется из-за употребления щелочной или кислотной воды, но ткани и органы тела, используемые для регулировки pH крови, меняют свой pH.
pH почек
На параметр pH почек оказывает влияние вода, пища, метаболические процессы в организме. Кислотная еда (например мясные продукты, молочные продукты и др.) и напитки (сладкие газированные напитки, алкогольные напитки, кофе и пр.) приводят к низкому уровню pH в почках, потому что организм выводит излишнюю кислотность через мочу. Чем ниже уровень pH мочи, тем тяжелее приходится работать почкам. Поэтому кислотная нагрузка, приходящаяся от такой еды и напитков на почки, называется потенциальной кислотно-почечной нагрузкой.
Употребление щелочной воды приносит почкам пользу — происходит повышение уровня pH мочи, снижается кислотная нагрузка на организм. Увеличение pH мочи повышает pH организма в целом и избавляет почки от кислотных токсинов.
pH желудка
В пустом желудке содержится не больше чайной ложки желудочной кислоты, выработанной в последний прием пищи. Желудок производит кислоту по мере необходимости при употреблении пищи. Желудок не выделяет кислоту, когда человек пьет воду.
Очень полезно — пить воду на пустой желудок. Показатель pH увеличивается при этом до уровня 5-6. Увеличенный pH будет иметь мягкий антацидный эффект и приведет к увеличению количества полезных пробиотиков (благотворных бактерий). Увеличение pH желудка повышает pH организма, что ведет к здоровому пищеварению и освобождает от симптомов расстройства желудка.
pH подкожного жира
Жировые ткани организма имеют кислотный pH, поскольку в них откладываются излишние кислоты. Организму приходится хранить кислоту в жировых тканях, когда она не может быть выведена или нейтрализована иными способами. Поэтому смещение pH организма в кислую сторону — это один из факторов лишнего веса.
Позитивное влияние щелочной воды на массу тела состоит в том, что щелочная вода помогает выводить из тканей излишнюю кислоту, поскольку помогает почкам работать более рационально. Это помогает контролировать вес, поскольку многократно снижается количество кислоты, которое тело должно «хранить». Щелочная вода также улучшает результаты здоровой диеты и упражнений, помогая организму справиться с излишней кислотностью, выделяемой жировыми тканями в процессе потери веса.
Кости
У костей щелочной pH, так как они в основном состоят из кальция. Их pH постоянен, но если кровь нуждается в регулировке pH, кальций забирается из костей.
Польза, приносимая щелочной водой костям, состоит в их защите, путем снижения количества кислоты, с которым организму приходится бороться. Исследования показали, что употребление щелочной воды снижает рассасывание костей — остеопороз.
pH печени
У печени слабощелочной pH, на уровень которого влияет и пища, и напитки. Сахар и алкоголь должны быть расщеплены в печени, а это приводит к излишкам кислоты.
Польза, приносимая щелочной водой печени, состоит в наличии в такой воде антиоксидантов; установлено, что щелочная вода усиливает работу двух антиоксидантов, находящихся в печени, способствующих более эффективному очищению крови.
pH организма и щелочная вода
Щелочная вода позволяет частям тела, сохраняющим pH крови, работать с большей производительностью. Повышение уровня pH в частях тела, отвечающих за поддержание pH крови, поможет этим органам оставаться здоровыми и работать оперативно.
Между приемами пищи Вы можете помочь Вашему организму нормализовать показатель pH, употребляя щелочную воду. Даже небольшое увеличение pH может оказать огромное влияние на состояние здоровья.
По данным исследований японских ученых, показатель pH питьевой воды, находящийся в диапазоне 7-8, повышает продолжительность жизни населения на 20-30%.
В зависимости от уровня рН воды можно условно разделить на несколько групп:
• сильнокислые воды 9.5
Обычно уровень рН питьевой водопроводной воды находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. В речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3.
ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
Кислотность почвы — важность pH грунта для растений
Важным параметром в агротехнике является кислотность почвы на приусадебном участке. До посадки плодовых деревьев, кустарников, овощей и ягод, а также для цветов необходимо учитывать показатели кислотности земли конкретно для каждого вида растений.

Не все садоводы-огородники знают о кислотности грунта, о ее показателях на собственном приусадебном участке и не могут грамотно посадить растения, чтобы получить хороший урожай. При покупке почвосмеси в магазинах многие видят непонятную аббревиатуру рН и цифровые значения на упаковках и не знают, что с этим делать. Мы расскажем о том, что же такое рН – кислотность грунта для растений (таблица), как ее измерить и дадим показатели кислотности для основных видов растений.

Что такое рН и ее значение
Окисляют землю ионы алюминия и водорода, тогда она начинает проявлять признаки кислот в своем составе. Чем больше ионов водорода будет в грунте, тем кислее он будет. Показатели кислотности обозначают термином – рН, что означает десятичную степень обратной величины уровня ионов водорода (Н+) – от 0 до 14. Нейтральной является кислотность с показателями – рН 7.0, ниже нейтральной кислотности почва будет кислой, выше нейтральной – она будет щелочной. Итак, кислотность почвы — это водородные показатели качества земли.
Важно знать. При наличии в земле марганца, железа, меди и цинка она будет кислой, а при наличии серы, молибдена, кальция и калия – щелочной. Кислая среда хорошо растворяет железо, цинк, бор, фосфор и марганец. Большое окисление или щелочение тормозит развитие растений.

Каждой культуре необходимы оптимальные значения кислотно-щелочного баланса (рН) грунта, при которых она будет наилучшим образом развиваться, цвести и плодоносить.
Классификация кислых почв
Показатели рН, которые относят к грунтам:
- самым кислым – 3,8 – 4,0;
- сильнокислым – 4,1 – 4,5;
- среднекислым – 4,6 – 5,0;
- слабокислым – 5,1 – 5,5;
- приближенные к нейтральной почве – 5,6 – 6,9.

Классификация щелочных почв
Показатели рН, которые относят к грунтам:
- самым щелочным – 11 – 14;
- сильнощелочным – 10;
- щелочным – 9;
- слабощелочным – 8;
- нейтральным – 7.
Почему меняется кислотность почвенной среды
Слабокислая либо нейтральная почвенная среда с показателями рН 5-7 подходит многим культурам. Но формирование кислотности почвы происходит от воздействия химического состава материала в ней. Например, если это известковые сланцы или грунт с известняком, то рН будет иметь изначально высокие показатели щелочей. Чтобы грунт стал кислее, должно пройти немало времени, больше, чем это понадобится песчаникам или почвам, образованным на гранитах. Геологический возраст земли также влияет на кислотно-щелочной баланс, а также на годовые осадки: испарение воды и остаточную влажность. При накоплении влаги в земле происходит выщелачивание растворимых солей и минералов, что повышает кислотность грунта в пределах корней растений.

Каждый урожай выносит из земли кальций, калий и магний, что делает ее кислее. Во влажных почвах органический материал имеет тенденцию разлагаться, это также увеличивает показатели кислот, особенно угольной. Если в мокрой земле мало кислорода, с водой будет реагировать углекислый газ, и будет образовываться угольная кислота. Чтобы показатели рН изменились естественным путем, необходимо много времени. Этот процесс можно ускорить самостоятельно, то есть вручную.
Как скорректировать кислотность
При многолетнем выращивании плодовых деревьев и кустов, агрокультур с регулярным применением удобрений и минеральных комплексов происходит изменение состава земли на разных участках огорода и сада и показателей рН. Среда у корней растений будет стремиться к окислению, особенно при кислотных осадках летом, в связи с нарушениями мировой экологии.
Даем рекомендации о том, как понизить или повысить кислотность почвы в огороде. Для коррекции кислотности проводят следующие работы:
- вносят удобрения, кальциевую и натриевую селитру, мочевину (карбамид), нитроаммофоску, разбавляют грунт другой плодородной земляной смесью, заменяют верхний слой почвы – для уменьшения показателей;
- вносят суперфосфат, сульфат калия, калийную соль – для повышения показателей.
Для повышения щелочи в грунте проводят известкование. А чтобы правильно подобрать дозу, нужно знать показатели степени окисления.

Проводят раскисление почвы весной и осенью:
1. Известью: гашеной пушонкой, туфом (ключевой известью), гажей (озерной известью), цементной пылью, молотым известняком (углекислой известью) и иными веществами.
Нужно помнить о том, что известь агрессивна, поэтому некоторое время растения могут не усваивать фосфор. Предпочтительнее вносить раскислитель под перекопку осенью, тогда к весне придут в равновесие химические процессы в почве. Необходимо вносить известь-пушонку (кг/м2):
- кислые – 0,5;
- средней кислотности – 0,3;
- слабокислые – 0,2.
Молотого известняка понадобится для грунтов (кг/м2):
- легких суглинков и супесей: кислых – 0,35-0,4, средних – 0,25-0,3, слабокислых – 0,2;
- средних и тяжелых суглинков: кислых – 0,55-0,6, средних – 0,45-0,5, слабокислых – 0,35 – 0,4.
2. Доломитовой мукой – измельченной горной породой – доломитом.
Ее вносят как весной при высаживании растений, так и осенью при перекопке земли. В доломитовой муке много магния, его требуют легкие почвы. Она хорошо разрыхляет вязкие глинистые почвы, улучшает их состав и структуру. Доломитка необходима для почв (кг/м2):

3. Золой древесной – натуральным удобрением.
В зависимости о породы дерева, его возраста и места произрастания, соли кальция в золе содержатся в разных количествах – 30-60%. Поэтому нормы внесения золы небольшие, а для того, чтобы полноценно раскислить почву нужно 1-1,5 кг/м2. Много веток деревьев для сожжения не бывает на участках, тогда сжигают сухую траву и сорняки. Такую золу вносят по 2.5 кг/м2. В качестве удобрения ее вносят из-за содержания кальция, фосфора, магния.
4. Гипсом – белым или желтым известковым минеральным веществом из класса сульфатов.
Он растворяется в грунте благодаря именно кислотам, а не воде. Вступая с ними в реакцию, гипс понижает до нормы рН и входит в пассивное состояние. При повышении уровня закисления он снова активизируется и продолжает реакцию. Необходимое количество гипса для почв (кг/м2):
- кислых – 0,4;
- средних – 0,3;
- слабокислых – 0,1 – 0,2.

5. Мелом – мягким белым известняком.
Его тщательно измельчают и под перекопку осенью вносят в грунт. Мел боится влаги, поэтому нужно его хорошо перемешивать с землей, чтобы не было комков. Необходимое количество муки из мела для почв (кг/м2):
Подробнее о показателях pH почвы для растений опишем в таблице ниже.

Как быстро определить рН
Фермеры отвозят пробы грунта в лабораторию или приобретают рН-метр – прибор для измерения уровня кислот, которые проявляются в растворе почвы. Но этот способ крайне неудобен из-за необходимости растворять горсти земли в дистиллированной воде, а образцы почвы изымать из глубины – 6 см. Кроме этого, нужно делать проверки земли на огороде в разных местах, совершая пробы по 5 раз с промежутками до 30 см.
Так как проверить кислотность почвы в домашних условиях нужно быстро и без излишних заморочек, то садоводы-огородники пользуются лакмусовыми полосками, фенолфталеином и метилом оранжевым. Эти проверочные вещества в кислой среде меняют свой цвет.

Важно знать. Комфортно себя чувствуют в нейтральных грунтах все виды и сорта капусты, свекла, чеснок и лук. Предпочитают слабокислые участки кабачки, огурцы, баклажаны, горох и картофель. Кислая среда идеальна для тыквы, моркови и томатов.
Обычный столовый уксус поможет провести тест, для чего горсть земли (1 ч. л.) заливают несколькими каплями жидкости на стекле. Пузырьки и шипение появятся при контакте с щелочной средой, если их нет, то она кислая.
Можно использовать краснокочанную капусту для теста. Тогда почвенный раствор отфильтровывают с использованием дистиллированной воды. Из капусты выжимают сок и добавляют в него несколько капель спирта. Раствор и капустно-спиртовую жидкость соединяют. Если цвет тестера стал более алым, почва кислая, если стал синим или фиолетовым – субстрат щелочной.

Если взять листки черной смородины – 10 шт., сделать настой в 0,5 л кипятка, затем добавить в остывшую жидкость субстрат и размешать, то можно определить среду земли. В кислой среде настой покраснеет, в нейтральной – станет синеватым, а в слабокислой – станет зеленым.
Сорняки также реагируют на рН, поэтому по ним можно судить о том, какая среда для них более комфортная. А именно:
- в кислой среде будет много расти крапивы, лютика ползучего, вереска, подорожника, щавеля обычного и конского, щучки и пикульника, белоуса и кислицы, лютика, поповника, сфагновых и зеленых мхов;
- в слабокислой среде придется бороться с клевером, березкой полевой, мать-и-мачехой, ромашкой непахучей, подорожником, фиалкой собачей и васильком луговым;
- нейтральная среда подходит для вьюнка полевого, адониса весеннего (горицвета), донника белого, осота огородного;
- щелочная – комфортная среда для дремы белой, горчицы полевой, живокости и мака-самосейки.

Рассмотрим таблицу кислотности почвы для растений (таблица):
Источники:
http://econet.ru/articles/167219-rol-rn-i-kislotno-schelochnogo-ravnovesiya-v-organizme
http://1ku.ru/obrazovanie/67689-kislaja-sreda-i-shhelochnaja-sreda-opredelenie-i-svojstva-ph-test/
http://lifezone.su/pokazatel-ph/
http://sadim.guru/kislotnost-pochvy-vazhnost-ph-grunta-dlja-rastenij/